|
En
France, c'est bien connu, nous n'avons plus de pétrole mais
nous avons encore des idées
Le
procédé DAVID
Préambule
La
gêne procurée par les mauvaises odeurs est devenue
un problème de société.
Certaines mauvaises odeurs sont, de plus, préjudiciables
à notre santé comme d'autres produits peu ou
pas odorants.
Les
odeurs nocives ou
non, que nous respirons quotidiennement sont déterminantes
pour notre bien-être et notre santé.
Avec le temps, l'individu parvient à s'habituer aux
mauvaises odeurs et celles-ci étant invisibles, aucune disposition
n'est généralement prise pour s'en protéger.
Qui
est l'inventeur ?
L'inventeur,
Ingénieur chimiste de Recherche & Développement en industrie
pharmaceutique, aujourd'hui chercheur indépendant, est le
neveu de André
Bondouy, le Président fondateur de la société
SEPPIC.
|
Le
procédé est né de l'imagination d'un chimiste normand
né dans
un village mythique qui
a vu circuler la toute première voiture munie d'un moteur
a explosion conçue par Édouard
Delamare-Deboutteville (1856
à 1901) qui eut l'idée en 1883 de doter un break de
chasse d'un moteur à gaz.
Mais l'expérience s'acheva abruptement par l'explosion
du récipient à gaz.
L'année suivante il conçut et fit rouler
la première voiture à pétrole actionnée
par un moteur à explosion.
|
|
Comment
est né le procédé DAVID ?
L'idée
du procédé est le résultat de l'observation de la réaction
d'une molécule organique avec un dérivé soufré très malodorant,
en l'occurrence la condensation entre le chloroéthanol
et le dodécylmercaptan, ayant donné naissance à une
nouvelle molécule organique parfaitement inodore très facilement
biodégradable.
Cette observation a été le déclic pour
rechercher un réactif simple et peu coûteux et
si possible facilement accessible.
Le procédé DAVID est ainsi né.
Les recherches ont été entreprises pour le choix d'une molécule
organique déjà commercialisée, d'un coût abordable, facile
et sûre d'utilisation.
Le procédé a ensuite fait l'objet d'un brevet
français et européen dont l'extension porte
jusqu'en 2035.
Le
procédé DAVID - Secteur industriel
Procédé
d'épuration d'effluents gazeux ou liquides contenant
des dérivés soufrés
Le
procédé est relatif à un l'épuration d'effluents
gazeux ou liquides contenant des dérivés soufrés (H2S , alcoyl-mercaptans
, SO2).
L'hydrogène
sulfuré est un gaz extrêmement toxique, malodorant même lorsqu'il
est présent en quantités très faibles, et corrosif.
Sa présence ainsi que celle des alcoyl-mercaptans qui présentent
les mêmes inconvénients que l'H2S du point de vue olfactif
dans les effluents (gazeux ou liquides), industriels en particulier,
représentent un danger considérable pour la santé des organismes
vivants ou de l'environnement végétal.
Il est donc de la plus grande importance dans la lutte contre
la pollution, d'éliminer l'hydrogène sulfuré ainsi que les
alcoyl-mercaptans présents dans les effluents industriels
(industries liées à l'énergie, chimie, industrie du bois,
du papier et de la viscose, industries de l'agro-alimentaire),
dans les déchets (industrie des sous-produits d'animaux, déjections
animales, déchets ménagers) ou dans les stations d'épuration.
La
présence du SO2 dans les effluents, industriels en particulier,
représente également un danger considérable pour l'environnement
végétal; en effet, son émission est responsable d'une augmentation
d'acidité dans l'atmosphère et génère le phénomène de pluie
acide.
Les industries productrices de SO2 sont notamment les raffineries,
les industries de traitement des déchets des hydrocarbures,
les industries chimiques (chimie minérale: production d'acide
sulfurique et d'oxyde de titane; chimie organique), les industries
du papier, les industries agro-alimentaires et les industries
des matériaux. Diverses solutions ont été proposées pour éliminer
ces différents composés soufrés des effluents (gazeux ou liquides).
 Comment fonctionne ce nouveau procédé ?
Comment fonctionne ce nouveau procédé ?
La
présente invention s'est donné pour but de pourvoir à un procédé
d'épuration d'effluents gazeux ou liquides contenant un ou
plusieurs dérivés soufrés, tels que H2S, mercaptans ou SO2,
qui élimine les inconvénients des solutions visant au même
but proposées dans l'art antérieur, notamment en ce que le
procédé selon la présente invention permet un rendement d'épuration
quantitatif de l'ordre de 100%, ne nécessite pas d'installation
particulière (utilisation de n'importe quelle colonne de lavage
de gaz, par exemple), et fournit un produit de substitution
stable, biodégradable et non toxique.
La présente invention a pour objet un procédé d'épuration
d'effluents (gazeux ou liquide) contenant des dérivés soufrés:
Hydrogène sulfuré, anhydride sulfureux, méthanethiol, éthanethiol,
1-propanethiol, 2-propanethiol, ter-butanethiol, les ponts
disulfures des alcanethiols, etc,…
Ainsi qu'une grande variété de composés soufrés comme les
thioesters (méthylthioacétate, methylthiobutanoate, methylthiopentanoate).
Les thioesters sont de trois types :
- Les
plus courants ont pour formule générale : R-C(=O)-S-R' et
sont dits S-thioester.
Cependant, ils en existe de formule R-C(=S)-O-R' (O-thioester)
et même R-C(=S)-S-R' qui sont dénommés dans ce dernier cas,
dithioester.
-
Les thioacétals, qui sont très utiles pour l'inversion de
polarité des groupes carbonyles , sont une famille spéciale
de thioéthers comme de thioesters. Ils ont pour formule
générale : R-C(-OR)-SR'.
-
Les composés de formule R-C(-SR)-SR' sont appelés dithioacétals.
caractérisé
en ce qu'il comprend:
(A)
l'alcalinisation de l'effluent à traiter à un pH > 9 en présence
d'une base de formule générale M-OH dans laquelle M représente
un métal alcalin, un métal alcalino-terreux, un agent de condensation
entre la partie organique d'un réactif spécifique et le dérivé
soufré ou un agent de transfert de phase et notamment un ammonium
quaternaire ou un ligand.
(B)
la mise en contact du produit obtenu en (A) avec un réactif
organique spécifique désigné par Z-Réactif. Le principe des
réactions chimiques sera schématisé comme suit:
-
cas d'un mercaptan:
R-SH + Z-Réactif + M-OH ----> R-S-Réactif + MZ + H2O
-
cas de l'hydrogène sulfuré:
H2S + 2 Z-Réactif + 2 M-OH ----> S-(Réactif)2 + 2 MZ + 2
H2O
-
cas de l'anhydride sulfureux:
SO2 + Z-Réactif + 2 M-OH ----> MSO3-Réactif + MZ + H2O
Selon
un mode de mise en oeuvre avantageux du dit procédé, les étapes
(A) et (B) sont réalisées simultanément.
Ce procédé de captage et de dépollution s'applique également
au traitement simultané de plusieurs dérivés soufrés, éventuellement
associés à d'autres gaz (acides ou autres).
 Description technique du procédé DAVID
Description technique du procédé DAVID
Le
procédé DAVID est mis en oeuvre dans un processus
de désodorisation physico-chimique consistant en un transfert
de molécules gazeuses odorantes vers une phase liquide. Ce
procédé se caractérise par un lavage chimique
de l'air vicié à contre courant, à l'aide de solutions aqueuses
alcalines, à l'intérieur de tours
de lavage placées en série.
Ces tours sont garnies de matériau inerte qui favorise le
contact gaz-liquide.
Suivant la nature du composé à éliminer, un agent neutralisant
basique est ajouté à l'eau de lavage afin d'accélérer le transfert
gaz-liquide, et ainsi augmenter l'efficacité du traitement.
L'addition complémentaire d'un réactif spécifique
contribue à son tour, non seulement à intensifier ce processus
de transfert, mais aussi à régénérer les eaux de lavage en
modifiant chimiquement les molécules absorbées qui possèdent
la propriété d'être inodores et biodégradables.
Le
procédé conforme à l'invention permet d'obtenir un produit
traité liquide absolument inodore et incolore qui peut être
directement évacué vers un bassin d'auto-neutralisation d'une
station d'épuration; de plus, l'acidification ne régénère
pas de mercaptan, de SO2 ou d'hydrogène sulfuré.
Le
procédé DAVID, revendiqué pour la destruction des odeurs,
repose sur la modification chimique de la molécule odorante
qui est transformée en une autre molécule " inodore " et non
toxique. On peut opposer cette nouvelle forme de
" désodorisation ACTIVE " face aux autres procédés
que nous qualifions " désodorisation PASSIVE " (masquages
ou neutralisateurs d'odeurs).
Le traitement biologique en station d'épuration ne crée pas
non plus de nouvelle nuisance, ni au niveau de la station
elle-même, ni au niveau du réseau d'assainissement.
Les mesures DBO (Demande Biologique en Oxygène) et DCO (Demande
Chimique en Oxygène) sont améliorées comparativement aux procédés
de destruction oxydants classiques.
Le procédé DAVID permet de traiter des effluents
gazeux très concentrés pouvant aller jusqu'à 100 mg/m3 de
composés odorants. Très fiable, cette technique atteint des
rendements épuratoires supérieurs à 99 % garantissant l'absence
totale de nuisances olfactives.
Les caractéristiques d'un matériau inerte qui favorise le
garnissage (nature, surface spécifique, volume, hauteur) sont
calculées pour optimiser le temps de contact gaz-liquide et
le transfert des molécules.
Le
captage et l'épuration par le procédé "DAVID", s'applique
aussi bien dans le cas de gaz pur, en qualité de mercaptan
ou d'H2S , qu'en mélange entre eux. Il permet aussi le captage
et la destruction d'autres substances chimiques nuisibles.
 Équipement nécessaire pour le procédé
DAVID
Équipement nécessaire pour le procédé
DAVID
Habituellement, on utilise des laveurs en série; le traitement
d'un mélange de polluants se fait en 2 ou 3 étages en série.
Le plus souvent un étage de traitement acide pour l'élimination
des composés azotés, suivi d'un étage de traitement basique
oxydant ou de traitement oxydant suivi d'un traitement basique.
Le
procédé conforme à l'invention ne nécessite en principe qu'un
seul étage de traitement
La présence d'une installation existante à 3
étages permettra d'implanter le procédé
DAVID sur ces 3 tours, augmentant d'autant la capacité
de traitement, tant sur la quantité que sur la durée.
Exemple
du procédé sur une installation existante à
3 étages:
 Démonstrations du procédé DAVID
Démonstrations du procédé DAVID
Une
feuille
de calcul permet d'évaluer la quantité de
réactif à mettre en oeuvre en fonction des polluants
à traiter.
Dans les cases bleues, il suffit de renseigner les flux et
les prix.
Les quantités de soude ou de potasse nécessaires
sont aussi déterminées. Le calcul donnera également
les quantités en eau
de Javel qu'il aurait été nécessaire
de mettre en oeuvre pour traiter cette même quantité
de polluants.
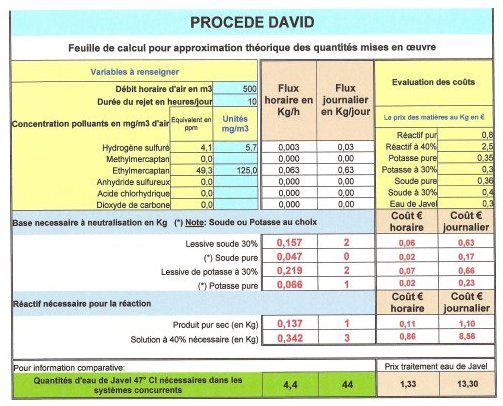
Pour
exemple: la feuille de calcul de la démonstration en
industrie pétrochimique.
Les prix indiqués sont par tonne ou par tonne métrique.
On notera, dans cet exemple, que le traitement à l'eau
de Javel coûte 12 fois plus cher que le traitement par
le procédé DAVID .
 Industrie pétrochimique
Industrie pétrochimique
Dépollution
d'un flux gazeux provenant de la sortie d'une unité de traitement
rejeté par une cheminée haute de 40 m.
COMPOSITION
DE L'EFFLUENT GAZEUX POLLUANT A TRAITER:
Flux d'air d'un débit de 1.000 (N)m3/H.contenant:
-
Hydrogène sulfuré 5,7 mg/(N)m3 (0,168 m.mole)
- Ethylmercaptan
125 mg/(N)m3 (2,016 m.mole)
- Gaz
carbonique (non quantitfié)
MATÉRIEL
PILOTE UTILISE POUR L'ESSAI:
-
Colonne d'absorption, hauteur: 3 m., surface de base: 0,28
m2 (diamètre 60 cm), garnissage à plateaux, dévésiculeur
en sortie d'air
-
Pompe de circulation des fluides réglable de 0 à 25 m3/H.
-
Vanne d'alimentation en effluent gazeux polluant réglable
de 0 à 1000 m3/H.
CHARGE
OPÉRATOIRE POUR LA DÉMONSTRATION :
-
Eau : 400 L.
-
Potasse à 30%: 5 Kg
-
Réactif: 3,5 Kg
Le
débit des gaz est fixé à 500 m3/H. et le débit de la pompe
de circulation de la solution de lavage à 11 m3/H.

Photo
d'une installation de captage similaire
|
CONCLUSIONS
DE LA DÉMONSTRATION:
Cette
installation pilote a permis une durée de fonctionnement
de 10 heures pendant lesquelles des contrôles réguliers
de l'efficacité ont vérifié l'absence des polluants
en sortie de l'installation pilote.
Dans
les systèmes concurrents la quantité d'eau de
Javel 47° Cl nécessaire aurait été de
44 Kg pour capter et détruire la quantité
équivalente de polluants. Avec le procédé
DAVID, il aura suffi de 1,4 Kg de réactif pur
ou 3,5 Kg de solution à 40%.
On
notera que le milieu réactionnel de l'eau de
Javel est environ 15 fois plus dilué que celui
du procédé DAVID.
|
 Station d'épuration urbaine
Station d'épuration urbaine
Comme
dans l'essai précédent, l'efficacité du procédé
"DAVID" a été testée sur une installation pilote
branchée en sortie d'une unité de bio-filtre d'une
des plus importantes stations urbaines de la région
parisienne.
Les polluants à traiter sont constitués d'hydrogène
sulfuré (H2S) et de methylmercaptan (CH3SH).
Les résultats ont été contrôlés
par analyse de l'air toutes les 4 minutes en CPG détecteur
FPD en isotherme à 60°.
Les mesures de concentration en H2S et CH3SH ont été
effectuées en entrée et en sortie du pilote
de désodorisation.
Le tableau suivant récapitule les principales valeurs
mesurées:
|
Entrée
du pilote de désodorisation
|
Sortie
du pilote après épuration par procédé
"DAVID"
|
|
H2S
en ppm
|
CH3SH
en ppm
|
H2S
en ppm
|
CH3SH
en ppm
|
27,8
18,8
18
10
7,4
45
115,8 |
4,1
4,1
4,1
3,55
3,55
4
4,1 |
inférieur
à la limite
de détection de
0,020 ppm |
inférieur
à la limite
de détection de
0,15 ppm |
Les
essais se sont déroulés sur deux jours sur une
unité mobile similaire à celle ci-dessous:

Voir
diverses unités de traitement
|
CONCLUSIONS
DE LA DÉMONSTRATION:
Cette
installation pilote en sortie de biofiltre a permis
une durée de fonctionnement de 2 jours pendant lesquels
des contrôles réguliers de l'efficacité ont vérifié
l'absence des polluants en sortie de l'installation
pilote.
|
 Les procédés concurrents
Les procédés concurrents
 Captage et destruction de l'hydrogène
sulfuré et des mercaptans
Captage et destruction de l'hydrogène
sulfuré et des mercaptans
Les
solutions actuellement adoptées dans l'industrie se rangent
dans les catégories suivantes:
 L'incinération des gaz polluants
L'incinération des gaz polluants
La
combustion de mercaptans ou d'H2S ne permet pas toujours
de très bons résultats tant en Papeteries, avec le procédé
de chaudière de régénération de la liqueur noire "basse
odeur", qu'en Pétrochimie dans la combustion par torchère
qui nécessite un système de neutralisation par précipitation
au chélate de fer.
Par ailleurs, cette solution présente de nombreux inconvénients:
-
a Production de gaz sulfureux.
- b
Coût énergétique très élevé.
 L'adsorption des mercaptans ou de l'H2S
L'adsorption des mercaptans ou de l'H2S
L'opération
consiste à transférer le composé à éliminer de la phase
gazeuse vers une phase solide. Le matériau le plus couramment
utilisé est le charbon actif qui se présente sous différentes
formes: grains, tissus... etc.
Afin d'accroître les performances, le charbon est parfois
imprégné d'aldéhyde notamment.
Dans le traitement des odeurs de mercaptans ou d'H2S ce
procédé ne présente pas d'intérêt économique (le charbon
saturé est remplacé par du neuf) et s'avère dangereux (forts
échauffements et risques d'incendie) lors de l'adsorption.
 La biodésodorisation
La biodésodorisation
La
biodégradation se produit dans un biofiltre où des micro-organismes
présents dans le garnissage absorbent les molécules malodorantes
et les oxydent grâce à leur complexe enzymatique.
Principe :
Air + H2S + NH3 + (...) + O2 --------> Matiere cellulaire
+ CO2 + H2O + H2SO4 + NH4 + (...)
Les
procédés de digestion anaérobie, appelés aussi méthanisation,
s'accompagnent de la production de biogaz riche en méthane
(65%) et en dioxyde de carbone (35%), avec des concentrations
plus ou moins faibles d'hydrogène sulfuré saturé en eau.
La bio-épuration de gaz tels mercaptans et H2S implique
la mise en relation biomasse/substrat; on peut réaliser
ce contact de plusieurs manières qui conduiront soit à un
bio-lavage soit à une bio-filtration.
Dans le cas du bio-lavage, les composés sont extraits avec
de l'eau qui les transporte jusqu'aux micro-organismes épurateurs.
Les micro-organismes peuvent aussi être présents dans l'eau
de lavage.
Dans le cas de la bio-filtration, les micro-organismes sont
présents sur le matériau qui est traversé par le gaz a épurer
.
Dans ces procédés l'épuration conduit à des co-produits
de métabolisation voire à une production de biomasse.
Les installations de bio-épuration occupent une place au
sol considérable sur le site d'utilisation et il faut souligner
une maintenance complexe.
Il faut rappeler la méthode de "masquage des odeurs" qui
est une méthode ancienne et inefficace à quelque distance
du lieu d'émission.
Une autre méthode consiste en une complexation de dérivés
soufrés par des composés aminés notamment des amino-alcools
mais nécessite par la suite la relibération des dérivés
soufrés piégés.
 Le lavage des gaz polluants
Le lavage des gaz polluants
La
méthode générale utilise le lavage du flux gazeux par une
solution aqueuse par transfert des composés à éliminer de
la phase gazeuse vers la phase liquide. Cette technique
s'accompagne souvent d'une réaction chimique.
-
Si le composé transféré ne subit aucune modification,
seule l'absorption physique intervient.
-
Si en phase liquide, pour améliorer la "solubilité apparente"
du produit a éliminer, on joue sur le pH pour favoriser
sa dissociation, le procédé est un transfert de masse
accompagné d'une réaction chimique instantanée.
Le
terme de lavage acido-basique désigne cette opération. L'emploi
d'un oxydant est susceptible à son tour d'augmenter l'efficacité
d'un lavage aqueux. La destruction par oxydation améliore
le transfert.
L'oxydation se superpose ou suit le lavage acido-basique.
L'opération est alors soit un lavage oxydant, soit un lavage
acido-basique suivi d'une oxydation.
Le captage des gaz à épurer est couramment effectué sur
des tours de lavages simples ou en série. Le transfert de
masse avec réaction chimique, suivant l'importance de l'effluent,
est effectué sur des colonnes à garnissage, à bulles ou
à plateaux; voire en cuves agitées. L'adjonction d'un oxydant
dans la solution aqueuse de lavage (chlore, eau oxygénée,
ozone) ou l'oxydation de cette dernière après le lavage
ont un double objectif:
- Éliminer
le polluant en accélérant le transfert de masse notamment
pour les mercaptans peu dissociés au pH de travail.
-
Oxyder le produit absorbé afin de régénérer en continu
la solution de lavage.
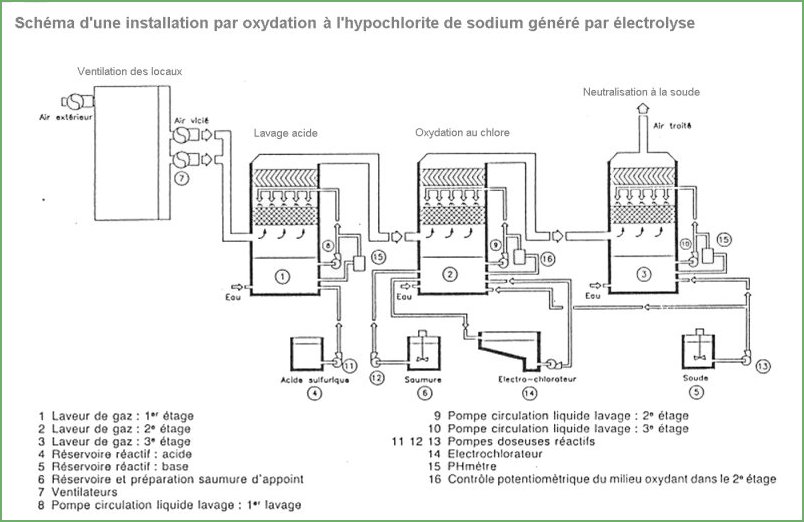
 L'oxydation des polluants
L'oxydation des polluants
1.
Le chlore et ses dérivés
Le
chlore est employé soit sous forme de chlore gazeux ou naissant,
soit sous forme d'hypochlorite ou de chlorite de sodium.
On aboutit soit à la formation d'acide hypochloreux: HClO,
soit à la formation de bioxyde de chlore: ClO2.
Il est à noter que le chlorite de sodium peut générer, selon
le pH de travail, des émanations gazeuses très irritantes
et suffocantes de bioxyde de chlore présentant, en outre,
des dangers d'incendies.
Le chlore naissant est aussi formé par électro-chloration
d'une solution d'hypochlorite ou de saumure de sodium. Les
réactions qui sont citées dans la littérature transforment
l'H2S soit en soufre colloïdal, soit en sulfates:
HS- + ClO - ------> S + OH - + Cl -
S2- + 4 ClO - ----> SO42- + 4 Cl -
Pour
arriver au stade de sulfate, la consommation théorique de
chlore est de 4 moles de Cl2 par mole d'H2S. En pratique
pour obtenir un rendement d'élimination supérieur à 99,8%
et une transformation quasi-totale en sulfate, la consommation
de chlore est de 5,2 moles par mole d'H2S détruit et une
consommation de soude d'environ
5 moles/mole.
L'action du chlore sur le méthylmercaptan est plus complexe.
Le premier produit d'oxydation est le diméthyl-disulfure
(CH3-S-S-CH3), lui-même très malodorant qui doit subir une
oxydation ultime jusqu'à l'acide méthyl-sulfonique
(CH3-SO3H). Pour éliminer ce type de composé soufré, l'emploi
d'un excès d'oxydant est nécessaire. Les rendements d'élimination
sont de l'ordre de 85 à 95% seulement même en utilisant
un excès de chlore à pH > 10. Les consommations de chlore
et de soude sont élevées (respectivement 8,5 et 7,6 moles/mole
de CH3SH éliminé).
Oxydant
très puissant, toujours produit in situ, dilué dans un gaz
contenant de l'oxygène (air ou oxygène pur). Lors de son
emploi par lavage et oxydation, il est nécessaire de le
transférer à la phase liquide, soit par un hydro-injecteur
dans le liquide avant l'opération de lavage, soit dans une
deuxième étape où il viendra oxyder le mercaptan ou l'H2S
absorbé.
En milieu aqueux H2S est oxydé par l'ozone principalement
sous forme de sulfate. Le pH se situe entre 9 et 11, les
consommations d'ozone varient entre 0,8 et 3 moles d'oxydant
par mole d'H2S. (effets d'auto décomposition et d'inhibiteurs
de radicaux libres).
Pour les mercaptans on devra augmenter au maximum le pH
(ionisation maximale) et tenir compte des effets de sel.
L'action
de l'eau oxygénée sur les mercaptans et l'hydrogène sulfuré
a fait l'objet de nombreuses publications. Une étude effectuée
en 1990, montre une consommation globale de 12 moles d'H2O2
par mole d'H2S détruit, alors que la consommation théorique
n'est que de 4 moles/mole et qu'en laboratoire, compte tenu
d'espèces intermédiaires moins oxydées formées, on ne consomme
instantanément que 2 moles/mole.
L'utilisation d'eau oxygénée pour épurer un milieu contenant
de l'H2S entraîne souvent la formation d'odeurs alliacées.

Exemple
d'unité de désodorisation sur 3 étages
en station d'épuration urbaine de traitement des
eaux usées.
4.
Le chélate ferrique
Les
procédés qui mettent en oeuvre un chélate ferrique permettent
d'obtenir directement du soufre élémentaire à partir de
gaz acides, de telle sorte qu'il n'y a pas de pollution
secondaire, éliminent de façon satisfaisante l'odeur de
l'hydrogène sulfuré mais peuvent exiger des conditions contraignantes
(pressions supérieures à l'atmosphérique, températures élevées).
Conclusions
sur l'oxydation
L'obtention
de rendements élevés exige des hauteurs de garnissage
de colonne importantes. La pratique courante met souvent
en jeu l'utilisation de laveurs en série. Le traitement
d'un mélange de polluants se fait en 2 ou 3 étages en
série. Le plus souvent un étage de traitement acide pour
l'élimination des composés azotés, suivi d'un étage de
traitement basique oxydant ou de traitement oxydant suivi
d'un traitement basique.
L'avantage principal du lavage réside dans son aptitude
à atteindre des bons rendements après optimisation des
procédés spécifiques mais l'inconvénient majeur vient
de la création d'une pollution liquide (fabrication importante
de sels et présence d'oxydants dans les rejets).
Le stockage et l'utilisation des oxydants nécessite
des précautions
particulières.
Les
méthodes de lavage précitées ont l'inconvénient majeur de
générer des produits de substitution eux-mêmes polluants
(certains sels ou des oxydants).
Exemples
d'installations de traitement d'air
 Captage et destruction du
dioxyde de soufre (SO2)
Captage et destruction du
dioxyde de soufre (SO2)
La
présence du SO2 dans les effluents, industriels en particulier,
représente également un danger considérable pour l'environnement
végétal; en effet, son émission est responsable d'une augmentation
d'acidité dans l'atmosphère et génère le phénomène de pluie
acide.
Les
solutions actuellement adoptées dans l'industrie se rangent
dans les catégories suivantes:
 Traitement par action à la source
Traitement par action à la source
- a-
Par modification des procédés utilisés, notamment
incinération (catalyse humide sur charbon actif,
traitement du combustible).
- b-
Par injection de désulfurant dans le foyer.
- c-
Par traitement des fumées:
-
lavage des gaz à la chaux hydratée,
-
procédé semi-sec (atomisation d'un lait de chaux),
- procédé
sec (injection de chaux pulvérulente).
En
pétrochimie divers procédés sont à ce jour utilisés parmi
lesquels :
-
Procédé Scott pour unité de traitement des gaz de queue
des unités Claus.
-
Procédé Clauspol.
-
Procédé Sulfacide (catalyse humide sur charbon actif).
En chimie la méthode la plus courante consiste à capter
le SO2 sur de la soude. La solution de sulfite de sodium
obtenue est souvent rejetée tel quel ou oxydée avant rejet.
 Captage du SO2 par la soude
Captage du SO2 par la soude
Les
méthodes d'épurations de SO2 ont, en particulier, l'inconvénient
majeur d'entraîner la formation de produits pouvant conduire
à une acidification néfaste de l'environnement.
LES
AVANTAGES DU PROCÉDÉ DAVID
Les
principaux avantages du procédé DAVID
Le
procédé DAVID est une technique originale d'épuration
d'effluents gazeux contenant des dérivés soufrés
malodorants et nocifs voire mortels comme l'hydrogène
sulfuré (H2S).
 Domaine
d'efficacité du procédé DAVID
Domaine
d'efficacité du procédé DAVID
Le
procédé s'applique dans le domaine du traitement des odeurs
générées par l'ensemble des dérivés soufrés du type Mercaptan
et Hydrogène sulfuré (H2S).
Ces pollutions olfactives se rencontrent dans de très
nombreux secteurs dont les principaux:
- Le
secteur industriel:
Les
activités industrielles.
- Le
secteur des déchets:
Les déchets ou leur transformation impliquent des
nuisances olfactives.
Il convient de comprendre le terme de déchets au sens
large: odeurs ménagères, carcasses d'animaux, déchets
de poissons, déjections d'animaux....
- Le
secteur de traitement des eaux:
Dans les stations d'épuration, les bactéries anaérobies
sont responsables d'émission d'H2S et de mercaptans rencontrés
dans les réseaux de collecte d'effluents et dans les stations
d'épuration.
Les unités de traitement des boues créent
aussi ces nuisances.
 Parfaite
intégration dans un système classique de lavage des gaz
sans autre installation particulière
Parfaite
intégration dans un système classique de lavage des gaz
sans autre installation particulière
Le
procédé DAVID consiste en un lavage basique couplé avec
une réaction chimique simultanée, destiné à capter puis
à transformer le polluant en un composé inodore.
Le captage et la destruction par contact gaz/liquide sont
généralement effectués par une méthode classique
à contre-courant dans des tours de lavage sur un ou plusieurs
étages.
Le procédé DAVID
ne nécessite pas d'installation particulière :
Le procédé s'intègre sur des installations déjà existantes
mais peut aussi se contenter d'une seule tour de lavage.
 Larges
possibilités d'utilisations en présence d'autres composés
Larges
possibilités d'utilisations en présence d'autres composés
Le
captage et l'épuration par le procédé "DAVID", s'applique
aussi bien dans le cas de gaz pur, en qualité de mercaptan
ou d'H2S , qu'en mélange entre eux.
 Rendement
et taux de conversion proches de la théorie
Rendement
et taux de conversion proches de la théorie
Le
réactif du procédé DAVID permet une forte amélioration du
transfert de masse gaz/liquide.
Le taux de conversion de la réaction chimique est quantitatif
pour une quantité de produit mise en oeuvre très
proche de la théorie.
Les composés
traités sont convertis à 100% en espèces biodégradables.
 Sécurité
et simplicité de la chimie du procédé
Sécurité
et simplicité de la chimie du procédé
Cette
réaction se réalise quasi instantanément lors de
l'opération de lavage à contre-courant sans
condition particulière de température ou de pression.
La mise en oeuvre du réactif est sûre et commode, elle ne
comporte pas les risques des oxydants et des dérivés chlorés
couramment utilisés.
Le réactif est un solide
pulvérulent, stable au stockage et à la manipulation.
 Le
composé de transformation obtenu est stable chimiquement
Le
composé de transformation obtenu est stable chimiquement
mais facilement biodégradable
L'effluent
liquide obtenu est parfaitement inodore, limpide et incolore.
La grande stabilité chimique du composé organique formé
rend impossible la génération d'une nouvelle pollution soufrée
gazeuse par émission de sulfures volatils, lors d'une acidification.
Le composé organique formé est parfaitement
bio-dégradable. La biodégradation est très rapide
et le traitement bactériologique ne crée pas de nouvelle
nuisance tant au niveau du réseau d'assainissement qu'au
niveau de la station elle-même.
 Des performances
techniques et économiques manifestes
Des performances
techniques et économiques manifestes
Les
unités de traitement existantes, conçues pour les techniques
courantes d'abattage aux oxydants, sont surdimensionnées
pour l'utilisation du procédé DAVID.
Le procédé DAVID permet une optimisation
des unités existantes et une diminution du coût d'une installation
à créer.
Avec le procédé DAVID, la consommation de
réactif est proche de la théorie ce qui le
différencie de la concurrence des procédés
oxydants qui demandent des excès de réactif
pour un résultat acceptable.
Avec
le procédé DAVID:
-
d'une part, le besoin en réactif est divisé par
un facteur compris entre 5 et 30 suivant le polluant traité
et suivant le réactif concurrent utilisé
de façon classique.
- d'autre
part, le coût de dépollution varie d'un facteur
de 4 à 25 suivant le polluant avec l'eau de Javel,
voire beaucoup plus avec le dioxyde de chlore ou le Perhydrol
(eau oxygénée).
Voir
les tableaux suivants:
Quantités
nécessaires en Kg pour traiter 1 Kg de polluant
| Pour
1 Kg |
Réactif
pur
|
Soude
pure
|
Soude
30%
|
Eau
Javel 47° Cl
|
Dioxyde
de chlore
|
Perhydrol
30%
|
| Hydrogène
sulfuré |
14,4
|
2,5
|
8,2
|
71,5
|
79,7
|
164,9
|
| Methanethiol |
2,7
|
0,9
|
3,1
|
82,7
|
79,8
|
82,7
|
| Ethanethiol |
2,1
|
0,7
|
2,4
|
64,1
|
61,8
|
64,1
|
| Propanethiol
1 ou 2 |
1,7
|
0,6
|
1,9
|
52,2
|
50,4
|
52,2
|
Rapport
pondéral entre les techniques concurrentes et le procédé DAVID
| Hydrogène
sulfuré |
5
|
6
|
11
|
| Methanethiol |
31
|
30
|
31
|
| Ethanethiol |
31
|
29
|
31
|
| Propanethiol
1 ou 2 |
31
|
30
|
31
|
Rapport
entre chacun des réactifs concurrents et le réactif
du procédé DAVID
Coûts comparés en € pour traiter 1 Kg de polluant
| Pour
1 Kg |
Réactif
pur
|
Soude
pure
|
Soude
30%
|
Eau
Javel 47° Cl
|
Dioxyde
de chlore
|
Perhydrol
30%
|
| Hydrogène
sulfuré |
5
|
0,4
|
1,8
|
19,3
|
70,9
|
67,6
|
| Methanethiol |
0,9
|
0,2
|
0,7
|
22,3
|
71
|
33,9
|
| Ethanethiol |
0,7
|
0,1
|
0,5
|
17,3
|
55
|
26,3
|
| Propanethiol
1 ou 2 |
0,6
|
0,1
|
0,4
|
14,1
|
44,8
|
21,4
|
Rapport
des coûts entre les techniques concurrentes et le procédé
DAVID
| Hydrogène
sulfuré |
4
|
14
|
14
|
| Methanethiol |
25
|
79
|
38
|
| Ethanethiol |
25
|
79
|
38
|
| Propanethiol
1 ou 2 |
24
|
75
|
36
|
Rapport
entre chacun desréactifs concurrents et le réactif
du procédé DAVID
En
résumé, l'analyse de ce tableau montre l'intérêt
économique du procédé DAVID face à
la concurrence:
|
Pour
1 kg de polluant
à traiter
|
Réactif
"DAVID"
|
Eau
de Javel
|
dioxyde
chlore
|
Eau
oxygénée
|
| Hydrogène
sulfuré |
5,00
€.
|
19,30
€.
|
70,90
€.
|
67,60
€.
|
| Méthylmercaptan |
0,90
€.
|
22,30
€.
|
71,00
€.
|
33,90
€.
|
| Dioxyde
de soufre |
Uniquement
le coût de la soude: 0.20€
|
Pas
de traitement connu
(uniquement captage à la soude)
|
 Des avantages
écologiques remarquables
Des avantages
écologiques remarquables
L'utilisation
du procédé DAVID permet une réduction
considérable des sels minéraux rejetés
après traitement, comme c'est le cas avec les traitements
oxydants (facteur compris entre 5 et 30 suivant le polluant
traité et suivant le réactif concurrent utilisé
de façon classique).
Le
procédé DAVID permet de s'affranchir des zones,
spécialement aménagée pour le stockage des réactifs, qui
sont très dangereux. Avec les traitements oxydants, Il est
courant de stocker ainsi:
- H2SO4
: 4 m3
- Eau
de Javel, NaClO à 47° chlorométrique: 40 m3.
Avec
le procédé DAVID qui met en oeuvre un réactif
"neutre" (ni oxydant ni réducteur), on
s'affranchit des risques tant du stockage que de l'utilisation.
NOUVEAUX
AVANTAGES ÉCOLOGIQUES DU PROCÉDÉ DAVID
Un
tout nouveau Procédé DAVID - Développement
durable est en étude.
D'ores et déjà, ont peut affirmer qu'il représente
une avancée écologique majeure.

RÉSUMÉ
DES POTENTIALITÉS CONCERNÉES PAR LE PROCÉDÉ
DAVID
-
les raffineries,
-
la pétrochimie,
-
les industries de traitement des déchets des hydrocarbures,
-
les industries de chimie minérale: production d'acide
sulfurique et d'oxyde de titane,
-
chimie organique et chimie fine,
-
les industries du papier, les industries
agro-alimentaires et les industries des matériaux,
-
les concepteurs et constructeurs de stations d'épuration,
-
les unités de stations d'épuration,
-
les unités d'abattage existantes,
-
les unités de bio-désodorisation,
-
les concepteurs et fabricants de colonnes d'abattage,
-
les instances territoriales (région, département,
agglomérations, communautés de communes
et communes)
|
|
![]() Valorisation
Valorisation