Purification
par lavage aux amines (Capture du CO2)
|
Les
amines sont bien connues pour leurs réactions réversibles avec le
CO2 , ce qui les rend idéales pour la capture de CO2 à partir de
plusieurs courants de gaz, y compris les gaz de combustion. A cet
égard, l'absorption sélective de CO2 par les alcanoylamines aqueuses
est la technologie la plus mature.
Pour
PTC System, nous avons jugé de l'importance d'une
élimination préalable du CO2 pour des raisons économiques
mais aussi de logistique.
Le module AmiWash trouve sa place pour la séparation
du CO2 qui sera rejeté ou recyclé avec une grande
pureté, évitant ainsi une pollution par H2S ou autre
gaz acide qui auront été captés au préalable
par le module AciWash.
Le
traitement des gaz par les amines désigne un procédé de séparation
des gaz utilisant des solutions aqueuses d'amines pour retirer des
gaz acides comme le sulfure d'hydrogène (H2S) et le dioxyde de carbone
(CO2) de mélanges gazeux.
Il s'agit de procédés courants dans l'industrie chimique.
Il est important de noter que le procédé aux amines
seul ne permet pas de séparer l'H2S du CO2. Ce dernier flux
gazeux ne peut être rejeté tel-quel à l'atmosphère.
Il devra subir un traitement.
Les
amines
Les
amines les plus utilisées sont:
-
-
la N-méthyldiéthanolamine (MDEA),
-
la diisopropylamine (DIPA),
Les DEA, MEA et MDEA sont les amines plus fréquentes dans les applications
industrielles, notamment pour retirer les composés du soufre dans
les hydrocarbures comme le gaz de pétrole liquéfié.
Il
faut deux molécules de MEA pour une molécule de CO2. Cette réaction
donne la MEA protonée et l’espèce carbamate.
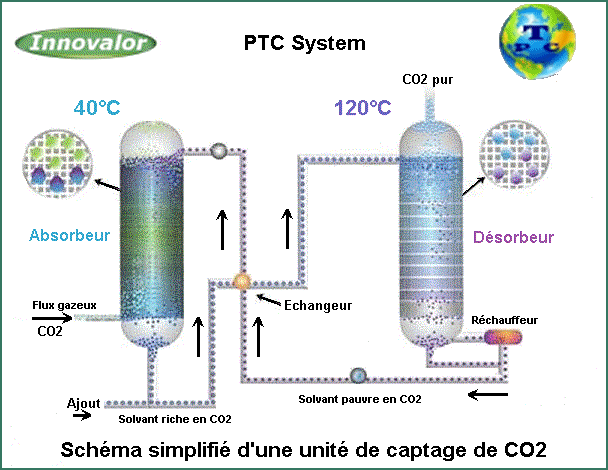
Le procédé de captage du CO2 est un procédé cyclique comportant
deux étapes (Figure suivante) :
Processus
de lavage des gaz par une solution d'amine.
-
Le gaz acide entre dans la tour du laveur et s'élève à
contre-courant de l'amine "maigre" descendante.
Tout au long de la colonne, la solution aqueuse d'amine réagit
sélectivement avec le CO2 par rapport aux autres gaz présents
dans les gaz (N2, O2, etc...)
- Le
gaz purifié s'écoule du haut de la tour.
En pied de colonne, on récupère la solution d’amine enrichie en
CO2
- La
solution d'amine est maintenant considérée comme riche et porte
des gaz acides absorbés.
- L'amine
"maigre" et l'amine "riche" traversent l'échangeur
de chaleur, chauffant l'amine "riche".
-
L'amine "riche" est alors encore chauffée dans la colonne
de régénération continue par la chaleur fournie par celle-ci.
La solution d’amine riche en CO2 passe dans un régénérateur (strippeur)
dont la température de fonctionnement est d'environ 120°C.
Elle est introduite en tête du régénérateur à contre-courant de
vapeur d'eau produite en fond de colonne par un rebouilleur.
Cette dernière permet de maintenir la température de fonctionnement
du régénérateur et de concentrer le CO2 en tête de colonne.
En effet, la vapeur produite dans le rebouilleur fournit l'énergie
nécessaire afin d'inverser la réaction amine-CO2 dans le sens
de la libération du CO2.
- La
vapeur qui s'élève à travers le reste libère H2S et CO2, régénérant
l'amine "riche" en amine "maigre".
- Les
gaz à vapeur et acides séparés de l'amine "riche" sont
condensés et refroidis.
En sortie du régénérateur, l’excès de vapeur d’eau est condensé
tandis que le CO2 est récupéré, puis comprimé pour être récupéré
pour valorisation ou évacué à l'atmosphère.
- L'eau
condensée est séparée dans l'accumulateur de reflux et est retournée
à l'eau.
- L'amine
chaude, régénérée et "maigre" est refroidie dans un
refroidisseur d'air/solvant et re-circulée sur la tour de lavage
pour effectuer un nouveau cycle d’absorption.
Principe
de l'absorption du CO2 par une amine:
Les
amines sont classées en trois catégories suivant le degré de substitution
de l'azote : primaire, secondaire et tertiaire (Figure suivante).
Selon
la structure de la molécule, le degré de substitution ou l'encombrement
stérique de l'atome d'azote, les réactions amine-CO2 sont différentes.
Leur site azoté basique leur confère une bonne réactivité avec les
gaz acides.
Les principaux solvants qui ont fait l'objet d'études sont les alcanolamines
telles que la Monoéthanolamine, la Diéthanolamine ou la N-méthyldiéthanolamine.
Leur fonction alcool leur assure une miscibilité totale dans l'eau
et abaisse également leur tension de vapeur.
Par
leur structure, les amines primaires ont des réactions différentes
des amines secondaires ou tertiaires avec le CO2.
-
L'amine
primaire MEA: Le CO2 contenu dans les gaz est absorbé par
la solution de monoéthanolamine selon la réaction suivante
:

-
Les
amines tertiaires comme secondaires ne formant pas de carbamates.
L'encombrement du site azoté provoque une instabilité des
carbamates.

En ce qui concerne la stabilité des carbamates, nous remarquons
que ceux issus de la MEA et de la 3-amino-1-propanol sont
les plus stables. Par contre à partir de la 4-amino-1-butanol,
les carbamates sont moins stables.
Parmi
les amines primaires, il existe des amines ayant la particularité
de contenir un site azoté stériquement encombré.
C'est le cas par exemple de l'AMP:

Nouvelle
approche avec le captage du CO2 par les acides aminés
Les
amines soumises à une décomposition partielle (chauffage,
oxydation) produisent des émissions de type ammoniacal.
Les acides aminés sont généralement des composées
stables
Nous
pensons étudier une solution aqueuse de sel de sodium de
ces acides
Eventuellement
en couplage avec 2-amino-2methylpropanol
- CAS N° 124-68-5 Prix: US $6-7/ Kilogram par 25 kg minimum
(Haihang) Supply Ability: 20 Ton/Tons per Month
FDS:
http://www.dcfinechemicals.com/files2/Hojas%20de%20seguridad%20(FR)/100571-SDS-FR.pdf
Voir
cinétique de réaction
de réaction du CO2 avec taurine et glycine
Voir sélection d'aminoacides
Généralités
sur l'absorption du CO2 par une amine:
La
concentration en amine d’une solution est également un facteur influençant
les isothermes d’absorption. le captage du CO2 par une solution
aqueuse d'amine tertiaire nécessite la présence d'eau pour former
les ions HCO3 - .
Plus la quantité d'eau en solution diminue, plus la formation d'hydrogénocarbonates
diminue et donc la capacité d'absorption du CO2 par la solution
aqueuse d'amine diminue.
La
connaissance de la réactivité du CO2 dans une solution d’amine en
fonction de la température est un paramètre important pour le procédé
de captage du CO2.
En effet, le solvant est aux alentours de 40°C dans la colonne d'absorption
et à environ 120°C au niveau de la colonne de régénération.
Des
recherches ont été entreprises afin de cumuler les avantages des
amines tertiaires (capacité d’absorption du CO2 élevée théorique)
à ceux des amines primaires ou secondaires (cinétique élevée théorique).
Les mélanges d’amines sont une alternative à l'utilisation de la
MEA seule.
L ’ajout d’une amine primaire (MEA) ou secondaire (DEA) en faible
quantité à une amine tertiaire (MDEA ou l'AMP) permet d’augmenter
la vitesse d’absorption du CO2 tout en conservant une énergie de
régénération faible.
Notamment, on remarque que la vitesse d’absorption du système AMP/MEA/H2O
est plus élevée que celle du système MDEA/MEA/H2O.
Ce résultat montre que la MEA ou la DEA peuvent être utilisées comme
"activateur" pour augmenter la vitesse de réaction de la MDEA ou
AMP.
D'autres molécules peuvent être utilisées comme le système MDEA/pipérazine.
L’ajout de pipérazine augmente la capacité d’absorption du CO2.
Cette dernière croit avec la concentration de la pipérazine pour
une concentration en MDEA fixée.
Néanmoins, la capacité d'absorption du CO2 de ces mélanges reste
relativement limitée.
Afin d'augmenter la capacité d'absorption du CO2, des équipes de
recherches se sont intéressé à des molécules contenant plus d'un
site azoté au sein de la structure. C'est ce que nous appelons les
multiamines.
Afin
de comparer les performances des amines, la grandeur pertinente
n'est pas le nombre de moles de CO2 par mole d'amine mais le nombre
de moles de CO2 par kilogramme de solution d'amine (mol CO2/kg).
Si nous prenons le cas d'un kg de deux solutions d’amines à même
pourcentage massique mais de masse molaire différente, pour un même
taux de charge d'amine (mol de CO2/mole d'amine), la solution aqueuse
d'amine ayant la masse molaire la plus faible capte plus de CO2
en mol/kg. Ceci car la même masse de solution contient un nombre
plus important de moles d'amine.
Pour obtenir le nombre de moles de CO2 par kilogramme (mol CO2/kg),
la relation est la suivante :

Pour augmenter la capacité d’absorption, deux paramètres sont à
ajuster:
- Soit,
la concentration en amine est augmentée et des problèmes de corrosion,
viscosité et dégradation sont observés.
-
Soit la masse molaire de l’amine est à diminuer. Dans ce cas,
si nous comparons une diamine et une monoamine ayant la même masse
molaire, nous pouvons potentiellement dans le cas de la diamine
avoir une capacité exprimée en mol de CO2/kg plus élevé car nous
avons deux sites qui réagissent avec le CO2.
Ainsi une molécule comme la N,N'-Dimethyl-1,6-hexanediamine
présente les meilleures caractéristiques d’absorption du CO2. La
capacité cyclique de cette amine est de 0,85 moles de CO2/mole d’amine.
Une
fonction alcool exerce un effet inductif attracteur. Nous remarquons
que plus la longueur de la chaîne carbonée augmente, plus l'effet
inductif attracteur de la fonction alcool diminue (le pKa du site
azoté augmente).
Dans
l'étude de l'effet encombrement stérique du carbone placé
en D du site azoté en considérant la monoéthanolamine (MEA)
Les résultats montrent que lorsque le carbone situé en position
alpha est encombré par un méthyle ou un éthyle, nous n'observons
aucun impact sur pKa.
Par contre, si nous considérons la MEA et la 2-amino-1-butanol,
nous observons que l'ajout d'un éthyle sur le carbone alpha encombre
le site azoté et la stabilité des carbamates diminue.
Le remplacement d'un éthyle par un méthyle ne montre pas de grands
effets sur les propriétés thermodynamiques.

La
présence de deux méthyles sur le carbone situé en D de la fonction
amine (cas de l’AMP) augmente l’encombrement du site azoté et il
en résulte une diminution du pKc*.
Nous observons également que lorsque nous passons de la MEA à l’AMP,
la capacité cyclique augmente. La forme de l’isotherme change avec
la modification de la structure et la capacité cyclique également.
Solutions
d'amines "industrielles"pour la purification de gaz.
Le lavage des gaz par une solution d'amine est une technologie éprouvée
qui élimine le H2S et le CO2 des flux de gaz naturel et d'hydrocarbures
liquides par absorption et réaction chimique.
Chacune des amines offre des avantages distincts à des problèmes
de traitement spécifiques.
- MEA
(monoéthanolamine)
-
Utilisé dans des applications de traitement de gaz naturel
à basse pression nécessitant des spécifications rigoureuses
de gaz de sortie
-
MDEA (Methyldiethanolamine)
-
Il a une affinité plus élevée pour le H2S que le CO2, ce qui
permet de réduire le "CO2" tout en conservant les capacités
d'élimination du H2S.
-
DEA (diéthanolamine)
-
Utilisé dans le traitement de pression moyenne à haute pression
-
Ne nécessite pas de récupération, tout comme les systèmes
- Mélange
pipérazine/N-méthylpipérazine/N,N’-diméthylpipérazine en solution
aqueuse pour le captage du CO2.
Un mélange pipérazine (PZ), N-méthylpipérazine (MPZ) et N,N’-diméthylpipérazine
(DMPZ) en solution aqueuse est décrit pour le captage du CO2 par
absorption-régénération.
Par rapport à la pipérazine concentrée, ce mélange permet un gain
sur la solubilité des produits solides et sur la chaleur d’absorption.
Aucune insolubilité n’a été observée à fort taux de charge en
CO2 contrairement aux solvants à base de pipérazine. Ce mélange
a montré des performances équivalentes à la pipérazine concentrée
en termes de capacité et de cinétique d’absorption du CO2, qui
sont plus que doublées par rapport à la traditionnelle MonoEthanolAmine
(MEA) à 7 M (30 % massique).
Un équilibre s’est établi entre les trois constituants qui augmente
la stabilité thermique en comparaison des mélanges traditionnels
de solvants.
Le principal inconvénient de ce nouveau système est une volatilité
plus importante des amines dans les conditions de l’absorbeur
en comparaison avec le cas de la pipérazine concentrée et de la
MEA.
- Un
article sur un mélange Pipérazine/MDEA :
https://www.protreat.com/files/publications/44/CO2_Removal_from_Syngas.pdf
Choix
d'amine pour AmiWash
Il
serait particulièrement intéréssant d'entrer
en contact avec AROL qui semble-t-il possède une gamme d'amines
appropriée et le savoir-faire à la capture du CO2.
Le
module AmiWash serait inspiré ou utiliserait la technologie
AE-AMINE de AROL qui présente les meilleures performances sur le
marché de l’épuration du biogaz pour la production de biométhane.
En
solution de repli, nous pensons à
un mélange pipérazine (PZ), N-méthylpipérazine (MPZ) ou N,N’-diméthylpipérazine
(DMPZ) et 2-amino-2-methylpropanol (AMP) en solution aqueuse.
-
-
-
-
Une
plaquette sur le captage du CO2 par la pipérazine:
-
|
L'absorption
proposée avec AmiWash
Toujours
sur la base du projet ISDND 1.000m3/h, le biogaz est composé
de:
- CO2:
30.2% (302 m3) soit 604 kg.
- Air
(O2: 4,8% et N2: 34,6%) : 39,4% (394 m3) - Stripping et transport
gazeux.
- Impuretés
diverses (composés minoritaires): 0.4 % (4 m3)
Ce
biogaz qui a été au préalable épuré
dans le module AciWash des composés fortement acides, tel
l'H2S est maintenant lavé à contre-courant par une
solution aux amines pour la décarbonatation.
* Simulation avec le mélange
N-méthylpipérazine (MPZ) + 2-amino-2-methylpropanol
(AMP) en solution aqueuse
Composition
de la solution d'amines:
- N-methylpiperazine
(MPZ) - 15% massiques (Effet très positif d’un activateur de
l’absorption)
- 2-Amino-2-methylpropanol
(AMP) - 45% massiques
- Eau
: 40% massiques
Cette
composition devrait permettre de tabler sur une absorption de
15 % massiques de CO2.
Les
amines:
*
Simulation avec le mélange
N-méthyltaurinate de sodium + 2-amino-2-methylpropanol
(AMP) en solution aqueuse
Composition
de la solution proposée:
- N-méthyl
taurinate de sodium 15% massiques - (Effet d'activateur de l’absorption)
- CAS
N° 43-16-9 (Ch3-NH-CH2-SO3Na) Producteurs
(Prix 1 à 5 $ US /kg)
- 2-Amino-2-methylpropanol
(AMP) - 45% massiques
- Eau
: 40% massiques
|